CTIS, un hito en la investigación clínica europea

“La implementación del CTIS es un paso crucial hacia un ecosistema de investigación clínica más eficiente y competitivo en Europa, beneficiando tanto a investigadores como a pacientes”: Lidya Domínguez, directora de investigación clínica de Sermes CRO.
Solo quedan 6 meses para la transición de todos los ensayos clínicos al CTIS

El 30 de enero de 2025 finaliza el plazo para la transición de ensayos clínicos a CTIS. Los estudios que continúen más allá de esta fecha deberán ajustarse a la Regulación de Ensayos Clínicos (CTR), que sustituye a la antigua CTD. En Sermes CRO nos unimos al esfuerzo que está realizando la EMA para comunicar este inminente cambio a los promotores de Ensayos Clínicos en Europa
Evaluación y aprobación de ensayos clínicos en CTIS: tiempos teóricos versus tiempos reales

Gestionar ensayos clínicos en la nueva plataforma europea de ensayos clínicos CTIS implica tener en cuenta no sólo los tiempos teóricos previstos en la EU CTR 536/2014 sino los tiempos reales que están tardando los Estados Miembros en evaluar y aprobar (en su caso) los ensayos clínicos presentados por esta vía
Bases de datos de Ensayos Clínicos: ¿cómo les afecta la nueva regulación europea CTR 536/2014?

Las bases de datos como ClinicalTrials.gov y REec (Registro Español de Estudios Clínicos) son fundamentales para el desarrollo y éxito de los ensayos clínicos. Estas permiten el registro y la divulgación de los ensayos clínicos en curso y sus resultados, lo que garantiza la transparencia y la accesibilidad de la información. A continuación, analizaremos en qué medida la nueva regulación 536/2014 les afectará en los próximos años y qué sucederá con EudraCT.
Analizamos la EU CTR y el CTIS en el congreso OCT Europe 2023

Raquel Reviejo, EU Regional Submmission Lead en MSD, y Lidya Domínguez, Clinical Research Director en Sermes CRO, analizarán los cambios surgidos de la puesta en marcha de la nueva plataforma de ensayos clínicos europea, CTIS, en el congreso Outsourcing In Clinical Trials Europe 2023, que tendrá lugar en Barcelona los días 3 y 4 de mayo.
¿Cómo hacer el registro en OMS para poder trabajar dentro de CTIS?

Para poder realizar un ensayo clínico en CTIS, previamente es necesario haberse registrado en OMS. En este artículo te contamos cuál es el proceso para el registro en OMS de promotores y centros que participan en ensayos clínicos
CTIS, año 2023: momento crítico en la gestión de ensayos clínicos en Europa

¿Qué cambia en enero de 2023 respecto a la gestión de ensayos clínicos en Europa? ¿Qué hemos aprendido en este primer año con la CTR 536/2014 en vigor y el CTIS en funcionamiento? ¿Cuánto tiempo queda para que se termine el periodo de transición que prevé la norma para que los promotores de los ensayos se adapten a la nueva situación?
¿Estamos sacando partido al nuevo portal europeo de ensayos clínicos, CTIS?
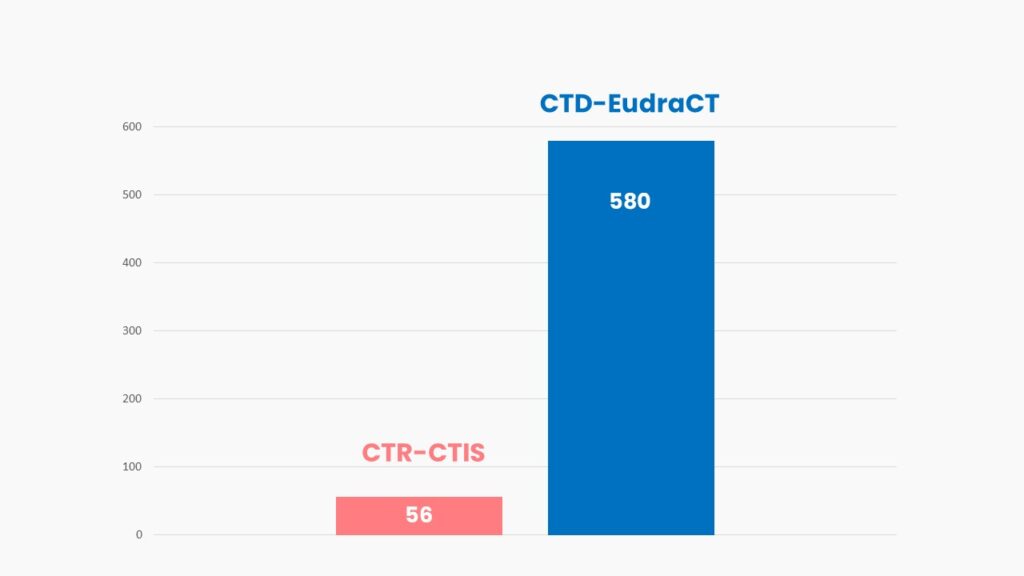
Analizamos los datos de uso del CTIS en sus primeros tres meses de funcionamiento y te damos a conocer el nuevo informe que la EMA publicará periódicamente con los principales KPIs. En él se realiza un seguimiento exhaustivo del ecosistema de ensayos clínicos europeo.
Celebramos la jornada «CTIS: plena aplicación del reglamento europeo de ensayos clínicos»

Los expertos participantes en la jornada “CTIS: plena aplicación del Reglamento Europeo de Ensayos Clínicos” coincidieron en valorar el CTIS como una herramienta que será de gran utilidad para la gestión de ensayos clínicos en Europa, al armonizar los requisitos entre países y centralizar toda su gestión.
Sermes CRO, primera empresa en gestionar la presentación de un ensayo clínico a través del CTIS

Sermes CRO, junto con Mikrobiomik, uno de sus promotores de cabecera, gestiona la primera presentación por parte de una Organización de Investigación por Contrato (CRO) de un ensayo clínico a través del CTIS (Clinical Trial Information System), el nuevo portal de ensayos clínicos europeo