
Menú
Nuestro Blog
Análisis de supervivencia con sapiencia
El análisis de supervivencia es una de las herramientas estadísticas más útiles e implementadas en los análisis de los ensayos clínicos, especialmente en el área de oncología. Aunque el nombre de esta técnica parece estar ligado al estudio de la supervivencia de los pacientes de los estudios, ¡es una técnica con gran polivalencia! Si quieres conocer más sobre las características y componentes básicos de este análisis, ¡sigue leyendo!
Por Mercedes Ovejero Bruna
Senior Statistician/Data Scientist de la Unidad de Bioestadística y Gestión de Datos de Sermes CRO
El análisis de supervivencia es una de las herramientas estadísticas más útiles e implementadas en los análisis de los ensayos clínicos, especialmente en el área de oncología. Aunque el nombre de esta técnica parece estar ligado al estudio de la supervivencia de los pacientes de los estudios, ¡es una técnica con gran polivalencia! Si quieres conocer más sobre las características y componentes básicos de este análisis, ¡sigue leyendo!
Por Mercedes Ovejero Bruna
Senior Statistician/Data Scientist de la Unidad de Bioestadística y Gestión de Datos de Sermes CRO

¿Para qué usamos el análisis de supervivencia?
En muchos estudios clínicos, una de las principales variables que se suele estudiar es el tiempo que transcurre hasta la ocurrencia de un evento determinado, por ejemplo, hasta que el paciente progresa de una patología, hasta que ocurre un efecto adverso, hasta que fallece, etc. Pero no solo se centra en eventos negativos, también podemos estudiar el tiempo que tarda un paciente en responder a un tratamiento o incluso el tiempo que transcurre hasta que recibe el alta hospitalaria.
De forma básica, lo que se estudia es el periodo que transcurre entre el inicio de seguimiento (previamente establecido) y la aparición del evento objetivo, o en su defecto, la finalización del periodo de seguimiento si no ocurre dicho evento. Por tanto, los análisis más elementales están compuestos por dos variables que se estudian de forma simultánea:
- Duración: tiempo que trascurre entre el momento de inicio marcado y la ocurrencia del evento o la finalización del periodo. Por ejemplo, número de semanas transcurridas desde la administración del fármaco hasta que ocurre un evento de interés. Si dicho evento no ocurre, la finalización del periodo suele coincidir con el final del estudio, la finalización del periodo de seguimiento, etc.
- Evento: Se trata de una variable que, en los análisis más sencillos tiene dos valores: ocurrencia o no del suceso de interés. Por ejemplo, esta variable podría ser la aparición de una nueva metástasis, el alta hospitalaria, etc. cuyos valores serían “sí” o “no”.
Si al paciente no le ocurre el evento en el tiempo considerado y por el motivo que sea, en el terreno de los análisis de supervivencia pasaría a denominarse “caso censurado”.
¡Ojo con la censura!
Como bien se ha indicado, los eventos de interés no siempre ocurren en tiempo de estudio estipulado. A estos casos se les llama censurados. Ahora bien, ¿por qué pueden aparecer los casos censurados? El origen de estos casos no tiene que ser necesariamente algo con connotación negativa, pero a continuación se listan algunas de las circunstancias que determinan la definición de los casos censurados de forma práctica:
- El paciente ha sido retirado del estudio antes de la finalización del tiempo de seguimiento.
- Las pérdidas de seguimiento. Este tipo de casos ocurren cuando no es posible localizar al paciente.
- El paciente ha tenido un evento diferente del de interés y no se dispone de más información.
- El paciente ha finalizado el tiempo de seguimiento sin experimentar el evento de interés.
- El paciente ha sido retirado del estudio prematuramente sin que se tenga constancia de que haya experimentado el evento de interés.
- No se dispone de información acerca de si el paciente ha tenido el evento o no. Estos casos son complejos de analizar dado que la situación del paciente es incierta en lo relativo al evento de interés.
En muchos de estos casos, lo que sucede es que no se tiene información del paciente hasta la finalización del tiempo de seguimiento, y, por tanto, lo único que se sabe es que en ese tiempo de observación el paciente no ha tenido el evento de interés. Lo que sí que es desconocido es si ha sufrido el evento en otro momento.
De forma técnica, los casos censurados se agruparían en casos censurados por la izquierda, por intervalo y por la derecha. Un análisis interesante sobre los tipos de casos censurados se encuentra en Leng et al. (1997). Aunque el análisis básico de supervivencia podría no tener en cuenta el tipo de caso censurado al que nos estamos enfrentando, es importante matizar que existen avances en la modelización por el tipo de caso censurado. La lectura de Turkson et al. (2021) permitirá hacerse una idea de cómo tratar estas circunstancias.
La receta de cocina (básica) del análisis de supervivencia
Los elementos básicos para preparar un buen análisis de supervivencia se pueden agrupar en:
- Requerimientos de los datos: La calidad de los datos en todos los análisis estadísticos es esencial. Si los datos obtenidos no tienen suficiente calidad o hay datos faltantes, es evidente que el análisis de supervivencia se verá seriamente afectado. Yendo de forma más específica, la información necesaria, como mínimo, tiene que ver con:
- El evento: Disponer de información acerca de si ha ocurrido el evento o no. La definición del evento debe de ser clara además de estar basadas en los objetivos de la investigación. Por ejemplo, si en un estudio de oncología, se puede analizar la supervivencia global (en inglés, Overall Survival), en este caso el evento sería que el paciente haya fallecido por cualquier causa en el intervalo de tiempo de interés.
- Las fechas: Se debe de disponer en todos los pacientes de la fecha de inicio del intervalo de interés, así como de, o bien la fecha del final del intervalo si no le ha ocurrido el evento, o, en caso contrario, la fecha en la que ocurrió el evento. Por ejemplo, si interesa la supervivencia global desde que se administró la primera dosis del tratamiento, se debe de disponer tanto de la fecha de administración del tratamiento, la fecha fin de estudio y la fecha de fallecimiento (si aplica).
- La función de supervivencia: Indica la probabilidad de que un paciente “sobreviva” más allá de un periodo de tiempo estipulado. Es importante no perder de vista que el concepto de “sobrevivir” es muy amplio. Por ejemplo, indicaría la probabilidad de que un paciente se recupere de su patología, o de que progrese en determinado momento de interés a los 6 meses.
- El estimador Kaplan-Meier: El estimador de Kaplan-Meier se utiliza en estos análisis porque, entre otros elementos, tiene en cuenta la censura de los casos. Existen otros métodos aparte del de Kaplan-Meier, para ampliar conocimientos, se sugiere la lectura de Xu et al. (2012).
¿Qué resultados básicos se obtienen en un análisis de supervivencia?
- Estimación de la supervivencia en cada intervalo temporal: Estos resultados se suelen ofrecer en formato de tabla y se expone cómo van cambiando los pacientes en riesgo de sufrir el evento en función del paso del tiempo. Suele ir acompañada de columnas que indican el tiempo evaluado, el número de pacientes en riesgo, el número de eventos acumulados, la probabilidad de supervivencia junto con su intervalo de confianza y el error típico de estimación.
- Estimación de la media, mediana y percentiles de los tiempos de supervivencia: Esta tabla resumen, permite visualizar los resultados para el grupo de pacientes de interés, además, se puede desglosar en función de variables como, por ejemplo, el grupo de aleatorización, así, no solo se puede estudiar si existen diferencias entre los grupos si no que, añadiendo un análisis inferencial, es posible comprobar si son significativas.
- La gráfica de supervivencia: Es una gráfica que, de forma muy visual, permite ir comprobando cómo la probabilidad del evento va variando conforme pasa el tiempo. En el ejemplo que se presenta a continuación, se observa que la probabilidad va bajando de forma bastante abrupta entre el momento 0 y a los 150 días. Además, también se ve en qué momento aparecen los casos censurados, marcados con | en la gráfica.
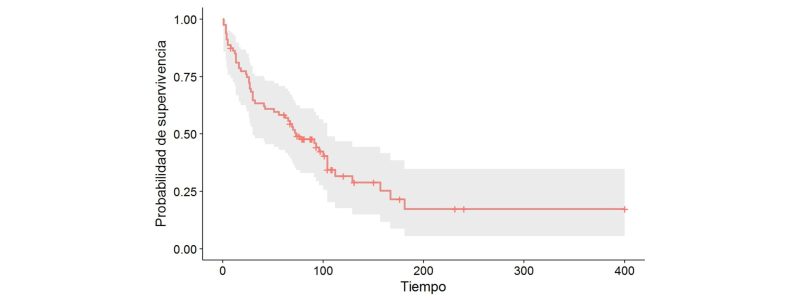
- Riesgo acumulado: esta función muestra la probabilidad de que a un paciente que está siendo observado en el tiempo “t” le suceda el evento de interés en ese momento. Permite responder preguntas como ¿cuál es la probabilidad que de fallezca un paciente que ha sido tratado con un medicamento experimental a los 6 meses (suponiendo que haya sobrevivido hasta ese momento)? Un ejemplo de esta gráfica se presenta a continuación.
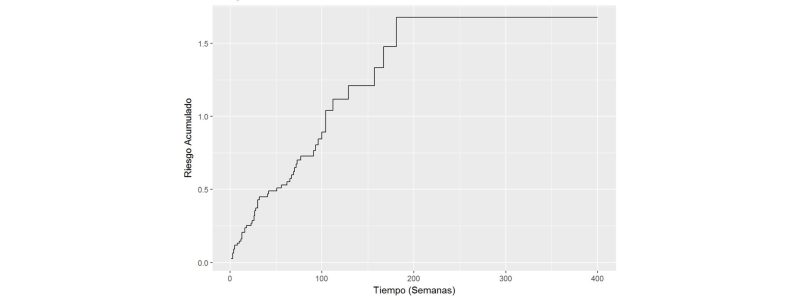
Mientras que la función de supervivencia se centra en informar sobre la «no ocurrencia» del evento (por ejemplo, el paciente no ha fallecido), la función de riesgo se centra en la «ocurrencia» del evento. Es muy interesante porque permite plantearse respuesta a preguntas como, por ejemplo, «¿en qué momento voy a tener un “pico” de altas hospitalarias?» Es muy curioso, pero esta función apenas se reporta y, como se ha visto, aporta información más que interesante en el área de los estudios clínicos.
Desafíos de estos análisis
A modo de conclusión, los análisis de supervivencia permiten estudiar el tiempo que transcurre hasta la ocurrencia de un evento determinado. Aunque los análisis básicos son muy intuitivos de interpretar, pueden convertirse en algo realmente complejo. Esto hace que sean un verdadero desafío en contextos como:
- La necesidad de incorporar diferentes covariables: Una de las posibles soluciones a este caso es la modelización mediante la regresión de Cox (una revisión de este modelo se puede encontrar en Fox y Weisberg, 2018). Estos análisis permiten estudiar la dependencia del tiempo de supervivencia considerando una serie de variables predictoras, como puede ser, el grupo de aleatorización, la edad de los pacientes, la gravedad de la patología, etc.
- Cuando el evento depende del tiempo: Se puede estar estudiando un evento de interés que es mucho más probable que ocurra al inicio del seguimiento que al final del estudio al considerar ciertos factores de riesgo. En esta situación conviene tener en cuenta que el modelo de riesgos proporcionales de Cox puede necesitar de ciertas extensiones (Kleinbaum y Klein, 2011).
- Un paciente puede sufrir más de un evento: esto es muy común cuando, por ejemplo, se estudian las recaídas, dado que un paciente puede tener más de una (Baethge y Schlattmann, 2004). En estos casos se deben de corregir los sesgos asociados a la censura dependiente de la supervivencia (Gómez, 2012; Ruth et al., 2022).
- Grandes volúmenes de datos: En ocasiones, el análisis incorpora gran cantidad de variables. Cuando el número de variables es muy amplio, los análisis se enfrentan al desafío de la alta dimensionalidad. El uso de herramientas de aprendizaje automático se presenta entonces como una alternativa óptima (un ejemplo de estas aplicaciones puede encontrarse en Gong et al., 2018).
Como recomendaciones de software libre, los paquetes survival y survminer de R, así como scikit-survival en Python son herramientas versátiles que permiten la elaboración de análisis de supervivencia tanto básicos como más avanzados.
Referencias
Baethge, C., & Schlattmann, P. (2004). A survival analysis for recurrent events in psychiatric research. Bipolar Disorders, 6(2), 115-121.
Fox, J., & Weisberg, S. (2002). Cox proportional-hazards regression for survival data. An R and S-PLUS companion to applied regression, 2002.
Gómez, G., & Serrat, C. (2014). Correcting the bias due to dependent censoring of the survival estimator by conditioning. Statistics, 48(2), 295-314.
Gong, X., Hu, M., & Zhao, L. (2018). Big data toolsets to pharmacometrics: application of machine learning for time‐to‐event analysis. Clinical and translational science, 11(3), 305-311.
Kassambara, A., Kosinski, M., & Biecek, P. (2021). survminer: Drawing Survival Curves using ‘ggplot2’. R package version 0.4.9, https://CRAN.R-project.org/package=survminer.
Kleinbaum, D. G., & Klein, M. (2012). Extension of the Cox proportional hazards model for time-dependent variables. In Survival analysis (pp. 241-288). Springer, New York, NY.
Pölsterl, S. (2020). scikit-survival: A Library for Time-to-Event Analysis Built on Top of scikit-learn. Journal of Machine Learning Research, 21(212), 1–6.
Prinja, S., Gupta, N., & Verma, R. (2010). Censoring in clinical trials: review of survival analysis techniques. Indian journal of community medicine: official publication of Indian Association of Preventive & Social Medicine, 35(2), 217.
Ruth, D. M., Wood, N. L., & VanDerwerken, D. N. (2022). Fully nonparametric survival analysis in the presence of time-dependent covariates and dependent censoring. Journal of Applied Statistics, 1-15.
Therneau, T. (2022). A Package for Survival Analysis in R. R package version 3.3-1, https://CRAN.R-project.org/package=survival.
Turkson, A. J., Ayiah-Mensah, F., & Nimoh, V. (2021). Handling Censoring and Censored Data in Survival Analysis: A Standalone Systematic Literature Review. International Journal of Mathematics and Mathematical Sciences, 2021.
Xu, S., Shetterly, S., Powers, D., Raebel, M. A., Tsai, T. T., Ho, P. M., & Magid, D. (2012). Extension of Kaplan-Meier methods in observational studies with time-varying treatment. Value in Health, 15(1), 167-174.
Certificados:














